再生医療等製品の開発は、従来の医薬品とは異なる複雑な課題に直面する場面が多く、承認までの道のりに不安を感じている方も多いのではないでしょうか。特に、日本独自の「条件付き・期限付承認制度」をいかに戦略的に活用するかが、早期実用化の鍵を握ります。本記事では、再生医療等製品の承認申請戦略について、PMDA相談の活用からGCTP適合性調査、市販後調査まで、成功確率を高めるための具体的なロードマップを解説します。開発期間の短縮と確実な承認取得に向けた一助となれば幸いです。
再生医療等製品の承認申請戦略の結論は「条件付き・期限付承認制度」の活用にある
再生医療等製品の承認申請戦略において、最も重要な柱となるのが「条件付き・期限付承認制度」の活用です。この制度は、有効性が推定される段階で早期に承認を与えるもので、開発期間の大幅な短縮を可能にします。ここでは、制度の背景や通常承認との違い、そして戦略の基盤となるTPP(ターゲット・プロダクト・プロファイル)の策定について詳しく見ていきましょう。
日本独自の「条件付き・期限付承認制度」が設けられた背景と目的
2014年の薬機法(旧薬事法)改正により導入された「条件付き・期限付承認制度」は、再生医療等製品の特性を考慮した画期的な仕組みです。
再生医療等製品は、細胞の不均一性などにより、短期間で有効性を確定するための大規模なデータ収集が困難な場合があります。そこで、安全性が確認され、かつ有効性が「推定」される段階で、条件および期限付きで特別に早期承認を与えることとなりました。
この制度の目的は、治療法がない、あるいは既存治療では不十分な患者様へ、いち早く革新的な医療を届けることにあります。開発側にとっても、早期の市場投入により投資回収を早められるという大きなメリットがあるのです。
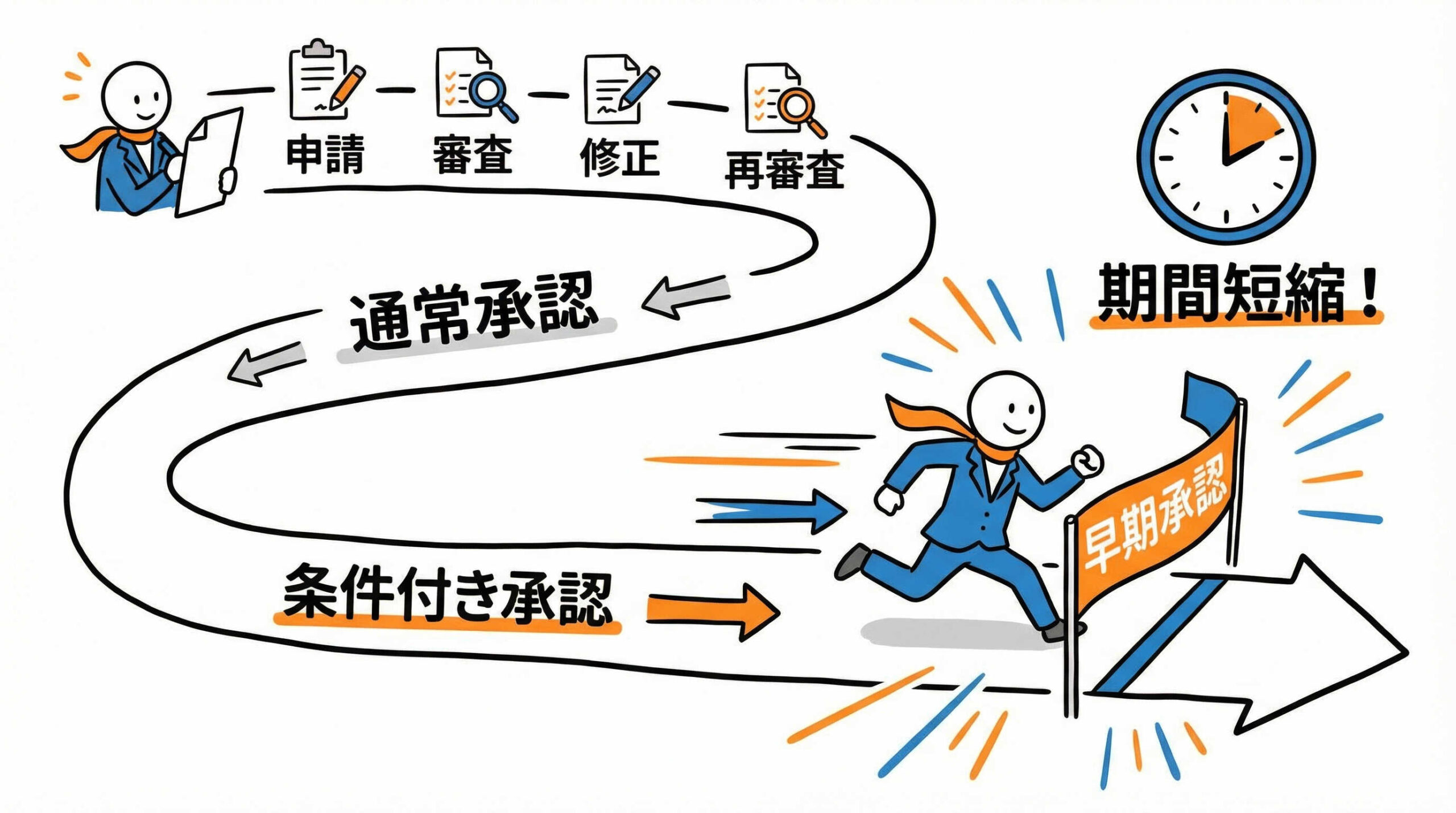
通常承認と条件付き承認における臨床データ要件の違い
通常の医薬品承認と条件付き承認の最大の違いは、求められる臨床データの「確度」にあります。通常承認では、検証的臨床試験(第Ⅲ相試験など)によって有効性を統計学的に「検証」することが必須です。
一方、条件付き承認では、探索的臨床試験の結果などから有効性を「推定」できれば承認の対象となり得ます。ただし、これは試験を免除されるわけではなく、承認後に全例調査などの厳格な製造販売後調査を行い、改めて有効性と安全性を検証することが条件付けられます。
| 項目 | 通常承認 | 条件付き・期限付承認 |
|---|---|---|
| 有効性 | 検証されていること | 推定できること |
| 臨床試験 | 検証的試験(P3)必須 | 探索的試験等で可 |
| 市販後 | 通常のPMS | 全例調査等による再検証 |
このように、市販後の負担と引き換えに、承認までのハードルを調整する戦略的な判断が求められます。
早期実用化を実現するためのターゲット・プロダクト・プロファイル(TPP)の策定
早期実用化を目指す上で、開発の羅針盤となるのが「ターゲット・プロダクト・プロファイル(TPP)」の策定です。TPPとは、製品が目指すべき効能・効果、用法・用量、対象患者層などを明確に定義した目標プロファイルのことです。
再生医療等製品では、開発初期から「条件付き承認」を狙うのか、あるいは「通常承認」を目指すのかによって、必要な非臨床試験や臨床試験のデザインが大きく異なります。
PMDAとの相談においても、TPPが明確でなければ建設的な議論はできません。早期の段階でTPPを策定し、それを基に規制当局と合意形成を図ることが、手戻りのない効率的な開発戦略につながるでしょう。
なぜ再生医療等製品には従来の医薬品と異なる開発戦略が必要なのか
低分子医薬品やバイオ医薬品の開発経験がある方でも、再生医療等製品の開発には特有の難しさを感じることがあります。それは、取り扱うものが「生きた細胞・組織」であることに起因します。ここでは、品質管理、臨床試験、非臨床試験の各側面から、なぜ従来とは異なるアプローチが必要なのかを解説します。
生きた細胞・組織を扱うことに起因する品質(CMC)の不均一性
再生医療等製品の最大の特徴は、原材料が生物由来の細胞や組織であり、本質的に不均一であることです。ドナーの個体差や採取部位、さらには培養条件のわずかな変化によっても、最終製品の品質(CMC)が変動する可能性があります。
従来の医薬品のように、化学合成によって均一な物質を大量生産することは困難です。「Process is the Product(プロセスこそが製品である)」と言われるように、製造プロセスの厳密な管理が品質保証の核心となります。
したがって、開発初期から原材料の管理、製造工程のパラメータ設定、そして品質特性解析(CQAの特定)に注力し、同等性・同質性を担保するロジックを構築することが不可欠です。
希少疾患やオーダーメイド治療における大規模臨床試験の実施困難性
再生医療等製品の多くは、希少疾患や難治性疾患を対象としています。そのため、従来の医薬品開発で求められるような数百人、数千人規模の二重盲検ランダム化比較試験(RCT)を実施することが物理的に困難なケースが少なくありません。
また、自家細胞を用いたオーダーメイド治療の場合、製造に時間がかかるため、プラセボ対照を置くことが倫理的・実務的に難しいこともあります。
このような状況では、外部対照(ヒストリカルコントロール)の活用や、少数例での統計解析手法の検討など、限られた症例数で科学的妥当性を説明するための高度な臨床開発戦略が求められます。
非臨床試験におけるヒト細胞由来製品の安全性評価の限界
ヒト細胞由来の製品を動物に投与しても、異種移植となるため、ヒトでの反応を正確に予測することには限界があります。免疫拒絶反応により細胞が早期に消失してしまったり、逆に動物特有の反応が出たりすることがあるからです。
そのため、従来の毒性試験をそのまま適用するのではなく、製品の特性に応じた適切な動物種の選択や、造腫瘍性(がん化のリスク)評価など、再生医療特有の安全性評価が必要となります。
場合によっては、in vivo(動物実験)だけでなく、in vitro(試験管内実験)のデータを組み合わせて安全性を立証する「WoE(Weight of Evidence)」アプローチが重要になるでしょう。
承認確率を高めるPMDA相談(対面助言)の効果的な活用ロードマップ
再生医療等製品の承認申請を成功させるためには、PMDA(医薬品医療機器総合機構)との対面助言を戦略的に活用することが不可欠です。開発の各ステージで適切な相談を行うことで、規制当局との合意形成を図り、手戻りを防ぐことができます。ここでは、具体的な相談の活用ロードマップについて解説します。
開発早期段階における「レギュラトリーサイエンス戦略相談」の重要性
開発の極めて早い段階、例えばアカデミアでの基礎研究から企業への導出前後などで活用したいのが「再生医療等製品レギュラトリーサイエンス戦略相談(RS戦略相談)」です。
この相談では、開発しようとする製品がそもそも再生医療等製品に該当するかどうか、また、将来的な承認申請に向けてどのような試験データが必要になるかといった大枠のロードマップについて指導を受けることができます。
早期にPMDAの考え方を確認しておくことで、無駄な試験の実施を避け、最短ルートでの開発計画を立案することが可能になります。まずはこの相談を通じて、開発の全体像をクリアにすることをお勧めします。
品質(CMC)に関する相談で合意形成を図るべき重要管理項目
品質(CMC)に関する相談は、承認申請の成否を分ける重要なポイントです。特に再生医療等製品では、規格試験の設定や製造方法の変更管理について、PMDAと綿密なすり合わせが必要です。
具体的には、ウイルス安全性評価、細胞の特性解析(純度、力価など)、不純物の管理基準などが議論の対象となります。
開発が進むにつれて製造スケールが大きくなることが一般的ですが、治験薬製造と商用製造での同等性をどう説明するか、どのタイミングで製造プロセスを固定(フィックス)するかについて、事前の合意形成が欠かせません。この合意がないまま進めると、データの取り直しという最悪の事態も招きかねません。
非臨床試験のパッケージ構成と安全性試験の省略可能性の検討
非臨床試験においては、必要最小限の試験でヒトでの安全性を説明するロジックが求められます。PMDA相談では、実施予定の動物試験プロトコルが妥当か、また、特定の試験(例えば生殖発生毒性試験やがん原性試験など)を省略できる科学的根拠があるかについて議論します。
再生医療等製品では、細胞の体内分布や微小環境での挙動が重視されます。既存の知見や文献データを活用し、科学的に不要と判断できる試験については積極的に省略の可能性を相談するべきです。
これにより、開発コストの削減と期間短縮、さらには動物愛護(3Rの原則)の観点からも適切な開発計画を策定できます。
治験プロトコル策定における主要評価項目の設定とPMDAとのすり合わせ
治験プロトコルの策定に関する相談は、承認申請に直結する最も重要なフェーズです。ここで特に重要なのが、主要評価項目(プライマリーエンドポイント)の設定です。
条件付き承認を目指す場合、どの程度の有効性が示されれば「推定」できたとみなされるのか、その閾値をPMDAと合意しておく必要があります。また、対照群の設定や症例数設計についても、統計学的な妥当性が厳しく問われます。
PMDAとの対話を通じて、臨床的意義があり、かつ実行可能な治験デザインを固めることが、成功への近道となります。相談記録は後の審査でも重要な根拠となるため、明確な言質を得ておくことが肝要です。
開発期間短縮に寄与する優先審査・指定制度の戦略的活用
開発スピードを加速させるためには、厚生労働省やPMDAが用意している優先審査・指定制度をフル活用する戦略が有効です。これらの制度に指定されることで、審査期間の短縮や優先的な相談対応など、様々な優遇措置を受けることができます。代表的な3つの制度について解説します。
先駆け審査指定制度の要件充足性と指定取得によるメリット
「先駆け審査指定制度」は、世界に先駆けて日本で革新的な医薬品等を開発・申請する場合に、優先的に審査を受けられる制度です。
指定を受けるためには、画期性、対象疾患の重篤性、極めて高い有効性、世界初であること(日本での早期開発)などの要件を満たす必要があります。
指定されるメリットは非常に大きく、優先相談の実施、事前評価の充実、そして総審査期間が通常の12ヶ月から6ヶ月へと大幅に短縮されることが期待できます。開発の早い段階からこの要件を意識し、指定獲得を目指すことは、競合優位性を築く上でも極めて有効な戦略です。
希少疾病用再生医療等製品指定制度(オーファン指定)の活用
対象患者数が少ない(5万人未満)難病などを対象とする場合、「希少疾病用再生医療等製品(オーファン製品)」の指定を目指すべきです。
この指定を受けると、優先審査の対象となるだけでなく、開発費用の助成金交付、税制措置(試験研究費の控除)、再審査期間の延長(最長10年)といった強力なインセンティブが付与されます。
また、PMDAの相談手数料が減額されるなどの経済的メリットもあります。希少疾患をターゲットとする再生医療等製品にとって、オーファン指定はビジネスモデルを成立させるための生命線とも言える制度でしょう。
サクラ(SAKURA)開花プロジェクトによる承認審査の迅速化
「サクラ(SAKURA)開花プロジェクト」は、PMDAが主導する承認審査の迅速化プロジェクトです。日本の審査ラグを解消し、世界最高水準の審査速度を実現することを目標としています。
このプロジェクトの下、PMDAは審査体制の強化や審査プロセスの効率化を進めています。申請者側としては、PMDAとのコミュニケーションを密にし、照会事項への回答を迅速に行うなど、プロジェクトの趣旨に沿った対応をすることで、審査期間の短縮という恩恵を最大限に受けることができます。
制度そのものではありませんが、PMDAの迅速化への姿勢を理解し、協調して審査を進める姿勢が重要です。
承認申請を見据えたGCTP適合性調査への対応と製造戦略
承認申請において、臨床データと並んで重要なのが製造管理・品質管理体制の確立です。再生医療等製品ではGMP(Good Manufacturing Practice)ではなく、GCTP(Good Gene, Cellular, and Tissue-based Products Manufacturing Practice)への適合が求められます。承認取得を見据えた製造戦略のポイントを解説します。
研究開発段階から商業生産への移行における「同等性・同質性」の評価
研究開発段階の小規模な製造から、治験、そして商業生産へとスケールアップする際、最大の課題となるのが製品の「同等性・同質性」の維持です。
手作業中心のプロセスから自動培養装置へ切り替える場合や、原材料のサプライヤーを変更する場合などは、変更前後で製品の品質が変わっていないことを科学的に証明しなければなりません。
この評価が不十分だと、それまでの臨床データが無効になるリスクさえあります。変更管理(Change Control)のプロセスを適切に運用し、各段階での品質データを蓄積して比較可能性を示すことが、スムーズな移行には不可欠です。
GCTP省令に準拠した製造管理および品質管理体制の構築
再生医療等製品の製造所は、GCTP省令に適合している必要があります。GCTPは、無菌操作の徹底や交叉汚染の防止など、細胞組織加工製品特有のリスクに対応した厳しい基準です。
ハード面(施設・設備)の整備はもちろんですが、ソフト面(手順書、記録類の整備、職員の教育訓練)の構築も同様に重要です。特に、製造管理者や品質保証責任者などの責任体制を明確にし、逸脱が発生した場合の対応手順などを定めておく必要があります。
承認申請時には実地調査または書面調査が行われるため、模擬査察を行うなどして、万全の準備を整えておくことが推奨されます。
外部委託(CDMO)を活用する場合のベンダー管理と責任分界
自社で製造施設を持たず、CDMO(医薬品開発製造受託機関)を活用するケースも増えています。この場合、委託者としての監督責任が問われます。
CDMOを選定する際は、GCTP適合の実績や技術力だけでなく、品質システム(QMS)の信頼性を厳しく評価する必要があります。
そして、委託者と受託者の間で「品質取決め書」を締結し、責任分界(どちらが何に責任を持つか)、逸脱時の連絡体制、変更時の承認フローなどを詳細に規定しておくことが極めて重要です。丸投げにするのではなく、パートナーとして共に品質を作り上げる姿勢が求められます。
条件付き承認取得後の市販後調査(PMS)と本承認への出口戦略
条件付き承認はゴールではなく、あくまで「仮のゴール」に過ぎません。承認取得後は、期限内に有効性を検証し、本承認(条件解除)を勝ち取るための活動がスタートします。ここでは、市販後調査(PMS)の重要性と、本承認へ向けた出口戦略について解説します。
条件解除に向けた製造販売後承認条件評価の計画策定
条件付き承認を取得する際、PMDAからは「承認条件」として、市販後に実施すべき調査の内容や症例数、期限などが具体的に提示されます。これに基づき、製造販売後承認条件評価の計画を策定します。
この計画は、単なるデータ収集ではなく、承認時に「推定」にとどまっていた有効性を「検証」するための臨床試験に近い性質を持ちます。
期限内に必要な症例数を集められなければ承認取り消しのリスクもあるため、実現可能な症例登録計画を立て、医療機関と連携して着実に遂行する体制構築が急務となります。
全例調査が求められる中でのリアルワールドデータ(RWD)の収集・管理
再生医療等製品の条件付き承認では、原則として投与される全患者を対象とした「全例調査」が求められます。ここで重要になるのが、リアルワールドデータ(RWD)の効率的な収集と管理です。
日常診療の中で得られるデータを、信頼性の高いエビデンスとして活用するためには、患者レジストリ(データベース)の活用が有効です。
日本再生医療学会が主導するNRMD(National Regenerative Medicine Database)などの既存レジストリを活用することで、データ入力の負担を軽減しつつ、質の高いデータを収集する仕組みを構築することが推奨されます。
市販後調査データの信頼性確保と再審査申請へのプロセス
市販後調査で得られたデータは、再審査申請(本承認への切り替え申請)の根拠資料となります。そのため、GPSP(Good Post-marketing Study Practice)省令を遵守し、データの信頼性(Data Integrity)を確保することが絶対条件です。
モニタリングや監査を適切に実施し、データの正確性を担保しなければなりません。期限が到来した際に、収集したデータに基づいて再審査申請を行い、有効性と安全性が改めて確認されれば、晴れて条件が解除され、通常の承認へと移行します。これが再生医療等製品開発の真のゴールと言えるでしょう。
まとめ
再生医療等製品の承認申請戦略は、日本独自の「条件付き・期限付承認制度」を軸に、開発早期からの綿密な計画が求められます。CMCの確立、PMDAとの対話、GCTP体制の構築、そして市販後を見据えた出口戦略まで、一貫したストーリーを描くことが成功への鍵です。制度を深く理解し、最適なパートナーと共に戦略的なロードマップを歩むことで、革新的な治療を待ち望む患者様へ、一日も早く製品を届けることができるでしょう。
再生医療等製品の承認申請戦略についてよくある質問

再生医療等製品の開発現場でよく寄せられる質問をまとめました。
- 再生医療等製品の承認申請から承認取得までの期間はどのくらいですか?
- 通常の審査期間の目標は12ヶ月ですが、優先審査品目や先駆け審査指定品目の場合は、目標期間が9ヶ月や6ヶ月に短縮されます。ただし、これは申請後の期間であり、事前のPMDA相談やデータ準備の期間を含めると、全体スケジュールはさらに長くなります。
- 海外で取得した臨床データを日本の承認申請に活用することは可能ですか?
- はい、可能です。ただし、民族的要因(内因性・外因性要因)の影響を評価する必要があります。PMDAは海外データの活用に前向きですが、日本人での安全性や有効性を確認するための「ブリッジング試験」や、一定数の日本人データの追加が求められるケースが一般的です。
- 「条件付き・期限付承認」の期限は通常どのくらいですか?
- 製品や対象疾患によりますが、一般的には7年を超えない範囲で設定されます。この期間内に市販後調査を実施し、有効性を検証して再審査申請を行う必要があります。期限内に検証できない場合、承認が失効する可能性があるため注意が必要です。
- 製造方法や原材料を変更した場合、どのような対応が必要ですか?
- 変更の程度に応じて、軽微変更届で済む場合と、一部変更承認申請(一変申請)が必要な場合があります。重要な変更の場合、変更前後の製品の同等性・同質性を評価するデータ(CMC比較試験、場合によっては非臨床・臨床データ)が必要になります。事前にPMDAに相談することを強く推奨します。
- カルタヘナ法への対応はどのタイミングで行うべきですか?
- ウイルスベクターを用いた遺伝子治療用製品など、遺伝子組換え生物等を使用する場合は、カルタヘナ法に基づく承認が必要です。これは薬機法の承認とは別枠の手続きであり、治験開始前(第一種使用規定承認)および製造販売承認申請時(第二種使用規定承認)に対応が必要です。審査に時間がかかるため、早期の準備が必須です。
<script type="application/ld+json">
{
"@context": "https://schema.org",
"@type": "FAQPage",
"mainEntity": [
{
"@type": "Question",
"name": "再生医療等製品の承認申請から承認取得までの期間はどのくらいですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "通常の審査期間の目標は12ヶ月ですが、優先審査品目や先駆け審査指定品目の場合は、目標期間が9ヶ月や6ヶ月に短縮されます。ただし、これは申請後の期間であり、事前のPMDA相談やデータ準備の期間を含めると、全体スケジュールはさらに長くなります。"
}
},
{
"@type": "Question",
"name": "海外で取得した臨床データを日本の承認申請に活用することは可能ですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "はい、可能です。ただし、民族的要因(内因性・外因性要因)の影響を評価する必要があります。PMDAは海外データの活用に前向きですが、日本人での安全性や有効性を確認するための「ブリッジング試験」や、一定数の日本人データの追加が求められるケースが一般的です。"
}
},
{
"@type": "Question",
"name": "「条件付き・期限付承認」の期限は通常どのくらいですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "製品や対象疾患によりますが、一般的には7年を超えない範囲で設定されます。この期間内に市販後調査を実施し、有効性を検証して再審査申請を行う必要があります。期限内に検証できない場合、承認が失効する可能性があるため注意が必要です。"
}
},
{
"@type": "Question",
"name": "製造方法や原材料を変更した場合、どのような対応が必要ですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "変更の程度に応じて、軽微変更届で済む場合と、一部変更承認申請(一変申請)が必要な場合があります。重要な変更の場合、変更前後の製品の同等性・同質性を評価するデータ(CMC比較試験、場合によっては非臨床・臨床データ)が必要になります。事前にPMDAに相談することを強く推奨します。"
}
},
{
"@type": "Question",
"name": "カルタヘナ法への対応はどのタイミングで行うべきですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "ウイルスベクターを用いた遺伝子治療用製品など、遺伝子組換え生物等を使用する場合は、カルタヘナ法に基づく承認が必要です。これは薬機法の承認とは別枠の手続きであり、治験開始前(第一種使用規定承認)および製造販売承認申請時(第二種使用規定承認)に対応が必要です。審査に時間がかかるため、早期の準備が必須です。"
}
}
]
}
</script>