再生医療分野における投資やライセンス導入の判断において、技術的な革新性と同じくらい、あるいはそれ以上に重要となるのが「薬事戦略」の確からしさです。どれほど優れたシーズであっても、規制要件を満たし、製造販売承認を得る道筋が見えなければ、事業としての価値は大きく損なわれてしまいます。
特に再生医療等製品は、従来の低分子医薬品とは異なる独自の規制枠組みや品質管理の難しさがあり、評価すべきポイントも多岐にわたります。本記事では、製薬企業の事業開発担当者様や投資家の皆様に向けて、再生医療における「薬事デューデリジェンスのポイント」を体系的に解説いたします。リスクを正しく評価し、成功への確かな一歩を踏み出すための一助となれば幸いです。
再生医療の薬事デューデリジェンスで見極めるべき3つの核心
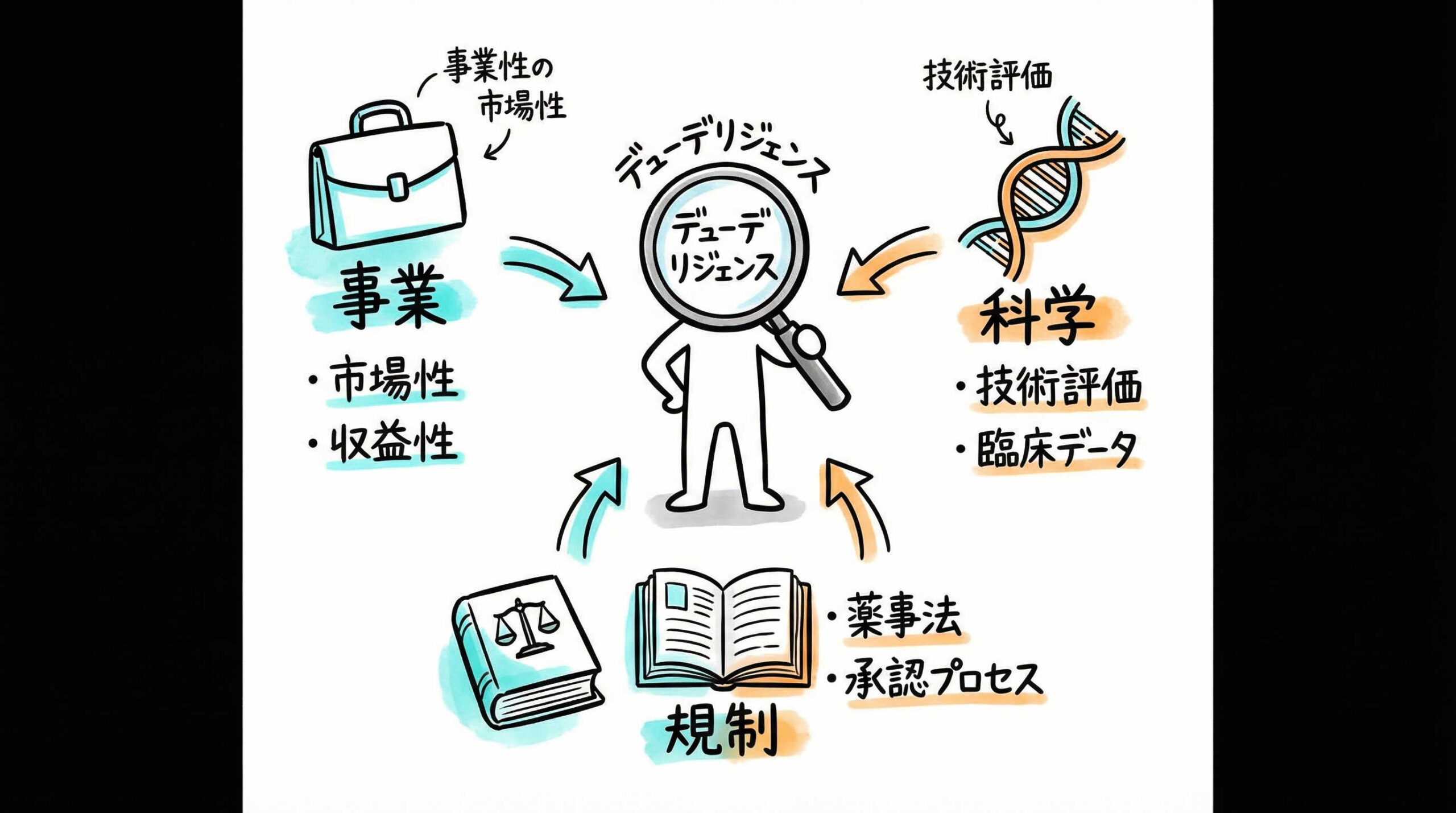
再生医療の薬事デューデリジェンス(DD)において、まず押さえておくべき全体像は何でしょうか。細かな技術論に入る前に、事業の成否を分ける大きな視点を持つことが大切です。ここでは、評価の軸となる3つの核心的なポイントについて解説いたします。これらを見極めることが、精度の高いDDへの第一歩となります。
規制要件への適合性とコンプライアンスリスクの有無
まず確認すべきは、対象となるシーズが現行の規制要件に適合しているか、そしてコンプライアンス上の重大な欠陥がないかという点です。再生医療等製品は、「再生医療等の安全性の確保等に関する法律(安確法)」や「医薬品医療機器等法(薬機法)」など、複数の法規制が複雑に関与します。
特に、初期の研究段階でアカデミアなどが実施した試験が、将来の承認申請に耐えうる基準(GCTPやGMPなど)で管理されていたかは重要なチェックポイントです。規制の解釈に齟齬があり、承認申請に必要なデータが不足しているとなれば、追加試験に多大な時間とコストを要することになります。法令遵守の姿勢と実績を、初期段階から厳しく評価しましょう。
開発データの信頼性および科学的な妥当性
次に、提示されたデータの信頼性と科学的な妥当性を精査します。どれほど魅力的なデータであっても、その取得プロセスが適切でなければ、規制当局への申請資料として使用することはできません。
データの完全性(Data Integrity)は、昨今特に厳しく問われている領域です。
- 生データは適切に保存されているか
- 解析方法は事前に定義されていたか
- 都合の良いデータのみを抽出していないか
これらを検証し、科学的なロジックが破綻していないかを確認します。特に再生医療では作用機序が複雑になりがちですので、得られた効果が科学的に説明可能であるかどうかも、デューデリジェンスの重要なポイントといえるでしょう。
商用化を見据えた製造プロセスの実現可能性とコスト構造
3つ目の核心は、実験室レベルの成功を商業レベルで再現できるかという「製造プロセスの実現可能性」です。手作業に依存した製造工程は、スケールアップの際に品質のばらつきやコスト高騰の原因となります。
- 原材料の安定供給は確保されているか
- 製造コストは償還価格(薬価)に見合う範囲に収まるか
- 自動化への移行は可能か
これらを早期に見極めることが肝要です。素晴らしい治療法であっても、製造コストが高すぎてビジネスとして成立しないケースは少なくありません。商用化を見据えたコスト構造の評価は、投資判断において決して外せない視点です。
再生医療分野で薬事DDが投資判断の最重要因子となる理由

なぜ、再生医療分野において薬事面の精査がこれほどまでに重視されるのでしょうか。それは、再生医療特有の「不確実性」と「規制の特殊性」が、事業価値に直結するからです。ここでは、一般的な医薬品開発との違いに触れながら、薬事DDが投資判断の最重要因子となる背景を紐解いていきます。
一般的な医薬品と比較した品質管理(CMC)の難易度と変動性
再生医療等製品の最大の特徴は、細胞という「生き物」を扱う点にあります。均一な化学合成が可能な低分子医薬品とは異なり、細胞はドナーの個体差や培養条件のわずかな変化によって、その品質や特性が変動しやすいものです。
この「品質の変動性」をいかに制御し、一定の規格内に収めるかという品質管理(CMC)の難易度は極めて高いといえます。CMC戦略の不備は、開発の遅延だけでなく、最悪の場合は開発中止にもつながりかねません。したがって、CMCの完成度を評価することは、プロジェクトのリスクを見積もる上で決定的な意味を持つのです。
「条件及び期限付承認制度」など特有の規制枠組みへの理解
日本には、再生医療等製品の実用化を促進するための「条件及び期限付承認制度」という世界に先駆けた独自の枠組みが存在します。この制度を有効活用できれば、早期の承認取得と収益化が可能となり、事業計画に大きなプラスのインパクトを与えます。
しかし、この制度の適用を受けるためには、推定される有効性と安全性のバランスについて、当局と綿密な合意形成が必要です。「制度を使えるだろう」という楽観的な観測で進めるのは危険であり、薬事DDの段階でその適用可能性を冷静に判断する必要があります。制度への深い理解なしに、正確な事業予測は立てられないでしょう。
薬事戦略の適否が承認取得時期と事業価値評価(バリュエーション)を決定づける背景
最終的に、薬事戦略の良し悪しは「いつ承認されるか」「どのような効能効果で承認されるか」を決定づけ、それが事業価値評価(バリュエーション)に直結します。
承認時期が1年遅れれば、特許期間の有効活用期間が短くなり、競合製品の参入を許すリスクも高まります。また、承認条件が厳しくなれば、対象患者数が限定され、売上予測も下方修正せざるを得ません。
つまり、薬事DDによって導き出される開発ロードマップの精緻さが、投資額やライセンス料の算定根拠そのものとなるのです。薬事リスクを織り込んだ適正な評価を行うことが、投資の成功には不可欠です。
【CMC・製造】品質及び製造管理における詳細チェックポイント
ここからは、より具体的な評価項目に入っていきましょう。再生医療において最も高いハードルとなりやすいのが、CMC(Chemistry, Manufacturing and Control)領域です。細胞製品特有の難しさを踏まえ、品質及び製造管理において必ずチェックすべき詳細なポイントを解説いたします。
原材料の適格性と生物由来原料基準への適合確認
細胞の培養に使用する培地や添加剤などの原材料が、規制要件を満たしているかの確認は基本にして最重要です。特に「生物由来原料基準」への適合性は必須チェック項目となります。
ヒトまたは動物由来の成分を含む場合、ウイルスやプリオンなどの感染性因子の混入リスクを排除する必要があります。
- 原産国はどこか
- 適切な不活化処理がなされているか
- 必要な証明書が入手可能か
これらが不明瞭な場合、代替原料への変更を余儀なくされ、開発の大幅な手戻りにつながる恐れがあります。初期段階で原材料の適格性を徹底的に洗い出しましょう。
ドナーのスクリーニング記録とトレーサビリティの確保
他家(同種)由来の細胞を用いる場合、ドナーのスクリーニング記録は極めて重要です。ドナーの適格性確認(問診、ウイルス検査など)が不十分だと、その細胞から製造された製品はすべて使用不可となるリスクがあります。
また、細胞採取から最終製品、そして患者への投与に至るまでのトレーサビリティ(追跡可能性)が確保されているかも確認が必要です。万が一の感染症発生時に遡って調査できる体制が構築されていなければ、安全性の担保はできません。記録の管理体制を含め、厳密なチェックが求められます。
製造工程の安定性と同等性・恒常性の実証データ
製造工程において、常に一定の品質の製品を作り続けられるかを示すのが「恒常性」であり、工程変更前後で品質が変わらないことを示すのが「同等性」です。
特に研究段階から治験薬製造、そして商用製造へとスケールアップする過程で、細胞の特性が変化してしまうことは珍しくありません。
- 製造ロットごとのばらつきは許容範囲内か
- 変更時の同等性評価計画は妥当か
これらを裏付ける実証データが存在するかを確認してください。データが不足している場合は、追加の検証試験が必要となり、コストと時間の増加要因となります。
GCTP省令への適合状況と無菌操作管理の信頼性
再生医療等製品の製造管理及び品質管理の基準である「GCTP(Good Gene, Cellular, and Tissue-based Products Manufacturing Practice)省令」への適合状況も確認が必要です。
特に細胞製品は最終滅菌ができないケースが大半であるため、製造工程全体を通じた無菌操作管理が品質保証の生命線となります。
- クリーンルームの管理状況
- 無菌性保証のバリデーションデータ
- 作業員の教育訓練記録
これらがGCTPの水準を満たしているか、あるいは満たすためのギャップ分析ができているかを評価します。現場の実態把握が欠かせません。
マスターセルバンク(MCB)及びワーキングセルバンク(WCB)の構築と特性解析
製品の出発物質となる細胞バンク(マスターセルバンク:MCB、ワーキングセルバンク:WCB)の品質は、製品の一生を左右します。セルバンクが枯渇したり、品質に問題が生じたりすれば、製品供給そのものがストップしてしまいます。
- MCB/WCBの製造履歴
- 特性解析(アイデンティティ、純度、安全性など)の結果
- 長期保存安定性のデータ
これらが十分に揃っているかを確認しましょう。また、将来的な需要に見合うだけのストックが確保できるか、あるいは再構築の計画があるかも重要な視点です。
製造所間の技術移転(テックトランスファー)の容易性とスケーラビリティ
開発段階ではアカデミアや小規模な施設で製造していても、商用化の際には大規模なCMO(医薬品製造受託機関)などへの技術移転が必要になることが多いでしょう。
しかし、細胞の培養技術は属人的な要素が強く、技術移転(テックトランスファー)が難航するケースが後を絶ちません。
- 製造手順書(SOP)は詳細に文書化されているか
- 特殊な手技や暗黙知に依存していないか
- スケーラビリティ(製造規模の拡大)を考慮したプロセスか
これらを評価し、スムーズな製造移管が可能かどうかを見極めることが、上市後の安定供給を占う鍵となります。
【非臨床・臨床】安全性・有効性評価における詳細チェックポイント
CMCと並んで重要なのが、非臨床および臨床試験における安全性・有効性の評価です。科学的なエビデンスが規制当局の求める水準に達しているか、客観的な視点で精査する必要があります。ここでは、特に注意すべき5つのチェックポイントをご紹介します。
Proof of Concept (POC) の確実性と作用機序の明確化
まず基本となるのは、Proof of Concept(POC:概念実証)が確立されているかです。動物モデルやin vitro試験において、期待される治療効果が示唆されているかを確認します。
さらに再生医療では、なぜその効果が出るのかという「作用機序(MOA)」の解明も重要視されます。細胞が定着して機能するのか、あるいはパラクリン効果(液性因子の放出)によるものなのか。作用機序が明確であればあるほど、臨床試験のデザインや有効性指標の設定が論理的になり、成功確率は高まります。曖昧なまま進んでいないか、注意深く見ていきましょう。
非臨床安全性試験のGLP準拠状況と実施項目の充足度
人を対象とする臨床試験に進む前の安全性確認として、非臨床安全性試験(毒性試験など)が適切に実施されているかは必須の確認事項です。これらの試験は原則としてGLP(Good Laboratory Practice)準拠の施設で実施される必要があります。
- GLP適用下で実施された試験か
- 試験項目はガイドラインに沿っているか
- 実施しなかった試験項目がある場合、その妥当性は説明できるか
特にGLP非適用のデータしかない場合、データの信頼性が問われ、再試験が必要になるリスクがあります。試験の質と網羅性を確認しましょう。
造腫瘍性評価など再生医療特有のリスク評価データ
再生医療特有のリスクとして最も警戒すべきなのが「造腫瘍性(腫瘍形成リスク)」です。移植した細胞が体内で異常増殖し、腫瘍化する可能性がないかを評価する必要があります。
特にiPS細胞やES細胞などの多能性幹細胞由来の製品では、未分化細胞の混入リスク評価が厳格に求められます。
- 造腫瘍性試験のデザインは適切か
- 長期的な観察期間は十分か
- リスク低減策は講じられているか
これらは患者さんの安全に直結する重大な項目であり、当局も最も厳しく審査するポイントの一つです。専門的な知見を持って評価する必要があります。
臨床試験プロトコルの妥当性と主要評価項目の設定根拠
臨床試験(治験)の計画そのものが適切でなければ、せっかくの製品も承認には至りません。プロトコルの妥当性を以下の観点から精査します。
- 対象疾患の選択基準・除外基準は適切か
- 主要評価項目(プライマリーエンドポイント)は治療効果を反映しているか
- 対照群の設定や症例数の設計根拠は統計学的に妥当か
特に再生医療では症例数が限られることが多いため、少ない症例でいかに有意差を示すか、あるいは臨床的意義を示すかという戦略が問われます。過去の類似薬の審査報告書なども参考に、成功の道筋が見えるかを確認しましょう。
データの完全性(Data Integrity)と原資料の管理状況
近年、規制当局による査察で頻繁に指摘されるのが「データの完全性(Data Integrity)」です。申請データの元となる原資料(カルテ、実験ノート、生データなど)が適切に管理され、改ざんや欠落がないことが求められます。
- データの修正履歴(オーディットトレイル)は残っているか
- アクセス権限の管理は適切か
- 紙媒体と電子データの整合性は取れているか
DDの段階でこれらを完璧に見抜くのは難しい場合もありますが、データ管理のSOPやシステムを確認することで、組織としてのデータに対する姿勢を推し量ることは可能です。信頼性の低いデータは、資産価値をゼロにしかねません。
【当局対応】規制当局との合意形成と法的要件の確認
技術的なデータが揃っていても、規制当局との合意形成ができていなければ、開発は前に進みません。当局との対話状況や法的な要件充足を確認することは、プロジェクトの現在地とゴールまでの距離を測る上で不可欠です。ここでは、当局対応に関するチェックポイントを整理します。
PMDA対面助言(事前面談含む)の議事録精査と指摘事項への対応履歴
開発の節目で実施されるPMDA(医薬品医療機器総合機構)との対面助言や事前面談の記録は、情報の宝庫です。ここには、開発上の課題や当局の懸念事項が如実に記されています。
- 当局からどのような指摘を受けたか
- それに対してどう回答・対応したか
- 重要な合意事項(「〜すれば承認申請可能」など)はあるか
議事録を精査することで、表面的な説明資料からは見えない「隠れたリスク」や「解決すべき宿題」を洗い出すことができます。当局の見解を無視して進めている箇所がないか、厳しくチェックしましょう。
開発ロードマップと規制当局の見解との整合性
企業が描いている開発ロードマップと、規制当局の見解にズレがないかも重要な確認ポイントです。例えば、企業側は「第2相試験終了後に申請可能」と考えていても、当局は「第3相試験まで必要」と考えているかもしれません。
この認識のギャップは、開発期間とコストの見積もりに致命的な誤差を生じさせます。
- 申請時期の想定は現実的か
- 条件及び期限付承認を目指す場合の要件はクリアできそうか
当局との合意に基づいたロードマップであるかを確認し、楽観的すぎる計画には修正を加える必要があります。
業許可(製造業・製造販売業)の要件充足と体制整備
再生医療等製品を製造・販売するためには、「再生医療等製品製造業許可」や「製造販売業許可」などの業許可が必要です。これらの許可を取得するためには、ハード面(設備)だけでなく、ソフト面(組織体制、GQP/GVP体制など)の要件も満たす必要があります。
- 製造所の許可区分は適切か
- 総括製造販売責任者などの三役体制は整備されているか
- 品質保証(QA)や安全管理(PV)の体制は十分か
特にベンチャー企業の場合、体制整備が追いついていないケースも散見されます。許可取得のハードルを正しく認識しているか確認しましょう。
カルタヘナ法および感染症予防法など関連法規制への対応
薬機法以外にも、再生医療には遵守すべき関連法規が多数存在します。
遺伝子組換え技術を用いる場合は「カルタヘナ法」への対応が必須となり、環境への拡散防止措置などが求められます。また、ヒト由来試料を扱う上での「感染症予防法」への適合も重要です。
これらの法律への対応が漏れていると、試験の実施が差し止められたり、承認審査がストップしたりする可能性があります。関連法規制の洗い出しと対応状況の確認は、コンプライアンスの観点からも欠かせません。漏れなく対応できているか、専門家の目を通すことをお勧めします。
知的財産権と薬事承認データの保護期間(再審査期間)の連動
最後に、知的財産権(特許)と薬事規制によるデータ保護期間(再審査期間)の兼ね合いを確認します。再生医療等製品は開発期間が長くなる傾向があるため、特許期間の延長登録出願などの戦略が重要になります。
また、希少疾病用再生医療等製品(オーファンドラッグ)指定を受けられれば、再審査期間が延長され、市場独占期間を長く確保できる可能性があります。
- 特許の残存期間は十分か
- 再審査期間を最大限活用する戦略はあるか
これらは将来の収益性に直結するため、法務・知財部門とも連携して評価することが大切です。
効果的な薬事デューデリジェンスを実施するための手順
ここまで多くのチェックポイントを見てきましたが、実際にこれらを網羅的かつ効率的に評価するには、適切な手順を踏むことが大切です。限られた時間の中で最大の成果を得るための、効果的な薬事デューデリジェンスの実施フローをご提案します。
開示資料(データルーム)のリストアップと不足資料の特定
DDの開始にあたり、まずは対象企業から開示された資料(バーチャルデータルーム等)のインデックスを確認します。ここでのポイントは、「何があるか」だけでなく「何がないか」に気付くことです。
- 最新の治験薬概要書(IB)はあるか
- PMDAとの議事録はすべて揃っているか
- バリデーションレポートは含まれているか
リストアップを行い、評価に不可欠な資料が欠けている場合は、速やかに追加開示を要求しましょう。初期段階での資料の網羅性が、その後の精査の質を決定します。Q&Aリストを作成し、管理することも効率的です。
薬事・CMC・臨床の専門家チームによる多角的な精査
再生医療のDDは高度に専門的であるため、一人の担当者ですべてをカバーするのは困難です。それぞれの領域に精通した専門家によるチーム組成が不可欠です。
- 薬事・規制担当: 法規制適合性、当局対応
- CMC担当: 製造プロセス、品質管理
- 臨床・非臨床担当: 薬理、毒性、臨床試験デザイン
- 知財・法務担当: 特許、契約
社内リソースだけで不足する場合は、外部のコンサルタントや専門機関(CROなど)を活用することも検討しましょう。多角的な視点からのクロスチェックが、リスクの見落としを防ぎます。
キーパーソンへのインタビューによる現場実態の把握
書面上の確認だけでは見えてこない実態を把握するために、対象企業のキーパーソンへのインタビューは非常に有効です。開発責任者、製造責任者、品質保証責任者などと直接対話することで、組織の成熟度やリスクに対する認識レベルを感じ取ることができます。
「なぜその判断をしたのか」「トラブル時の対応はどうだったか」といったプロセスを問う質問を投げかけてみてください。回答の整合性や具体性から、文書には残らない現場の”温度感”や潜在的な課題を掴むことができるでしょう。
検出されたリスクの重大度分類とディール条件への反映
すべての調査が終わったら、検出されたリスクを整理し、その重大度を分類します。
- Deal Breaker(致命的): 解消不可能で、取引中止に値するリスク
- Major(重大): 解消に多大なコストや時間を要し、バリュエーションに影響するリスク
- Minor(軽微): 今後の管理で対応可能なリスク
この分類に基づき、最終的な投資判断や契約条件(マイルストーン設定、表明保証条項など)への反映を行います。リスクを単に恐れるのではなく、契約によってコントロール可能な形に落とし込むことが、DDの最終的なゴールです。
まとめ

再生医療における薬事デューデリジェンスのポイントについて、核心となる3つの視点から、CMC、非臨床・臨床、当局対応の詳細なチェック項目、そして実施手順までを解説いたしました。
再生医療は科学的な可能性に満ちた分野ですが、それを患者さんに届ける事業として成立させるためには、薬事規制というハードルを確実に越えていく必要があります。薬事DDは単なる「粗探し」ではなく、事業の成功確率を高め、適切な資産価値を見出すための「羅針盤」です。
本記事で挙げたポイントを参考に、リスクとリターンを正しく見極め、自信を持って次の一手を打っていただければ幸いです。綿密な調査と準備が、革新的な医療を社会に実装する確かな力となるでしょう。
薬事デューデリジェンスのポイントについてよくある質問

再生医療の薬事デューデリジェンスに関して、現場でよく聞かれる疑問をQ&A形式でまとめました。投資判断や実務の参考としてお役立てください。
-
Q1. 通常の医薬品と再生医療等製品のDDで、最も大きく異なる点は何ですか?
- A1. 最大の違いはCMC(品質管理)の難易度です。生きた細胞を扱うため品質が変動しやすく、製造プロセスの安定性や同等性の証明が非常に困難です。また、条件及び期限付承認制度など独自の規制枠組みへの理解も不可欠となります。
-
Q2. 薬事DDは開発のどの段階で実施するのが最適ですか?
- A2. 早ければ早いほど良いですが、特に本格的な投資やライセンス導入を検討する段階(例えば非臨床試験終了前後や第1相試験前後)では必須です。早期にリスクを特定できれば、開発計画の修正や契約条件への反映が可能になります。
-
Q3. 外部の専門家を使わずに社内だけでDDを完結させることは可能ですか?
- A3. 社内に再生医療の薬事、CMC、臨床開発に精通した専門家が揃っていれば可能です。しかし、規制は常に変化しており高度な専門性が求められるため、客観的な評価を得るためにも外部コンサルタントの活用を推奨するケースが多いです。
-
Q4. 薬事DDには通常どのくらいの期間が必要ですか?
- A4. 対象品目の開発段階や資料の量によりますが、一般的には1ヶ月〜3ヶ月程度を要します。資料の開示状況やインタビューの調整、専門家による詳細な精査とレポート作成を含めた期間を見積もっておく必要があります。
-
Q5. 再生医療のDDで最も多く見つかる「失敗要因(Deal Breaker)」は何ですか?
- A5. 「原材料の記録不備(トレーサビリティ欠如)」や「製造プロセスの同等性が示せないこと」が多く挙げられます。これらは後から修正が効かず、データを一から取り直す必要があるため、致命的な欠陥となりやすいポイントです。
<script type="application/ld+json">
{
"@context": "https://schema.org",
"@type": "FAQPage",
"mainEntity": [
{
"@type": "Question",
"name": "通常の医薬品と再生医療等製品のDDで、最も大きく異なる点は何ですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "最大の違いはCMC(品質管理)の難易度です。生きた細胞を扱うため品質が変動しやすく、製造プロセスの安定性や同等性の証明が非常に困難です。また、条件及び期限付承認制度など独自の規制枠組みへの理解も不可欠となります。"
}
},
{
"@type": "Question",
"name": "薬事DDは開発のどの段階で実施するのが最適ですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "早ければ早いほど良いですが、特に本格的な投資やライセンス導入を検討する段階(例えば非臨床試験終了前後や第1相試験前後)では必須です。早期にリスクを特定できれば、開発計画の修正や契約条件への反映が可能になります。"
}
},
{
"@type": "Question",
"name": "外部の専門家を使わずに社内だけでDDを完結させることは可能ですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "社内に再生医療の薬事、CMC、臨床開発に精通した専門家が揃っていれば可能です。しかし、規制は常に変化しており高度な専門性が求められるため、客観的な評価を得るためにも外部コンサルタントの活用を推奨するケースが多いです。"
}
},
{
"@type": "Question",
"name": "薬事DDには通常どのくらいの期間が必要ですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "対象品目の開発段階や資料の量によりますが、一般的には1ヶ月〜3ヶ月程度を要します。資料の開示状況やインタビューの調整、専門家による詳細な精査とレポート作成を含めた期間を見積もっておく必要があります。"
}
},
{
"@type": "Question",
"name": "再生医療のDDで最も多く見つかる「失敗要因(Deal Breaker)」は何ですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "「原材料の記録不備(トレーサビリティ欠如)」や「製造プロセスの同等性が示せないこと」が多く挙げられます。これらは後から修正が効かず、データを一から取り直す必要があるため、致命的な欠陥となりやすいポイントです。"
}
}
]
}
</script>